e-ISSN 2953-5441
Vol.2(2):121-127
ARTÍCULO
 Discriminación de Perfiles Específicos de Ácidos Biliares Fecales
de Hippocamelus antisensis (Cervidae) y Especies Simpátricas Mediante Cromatografía
en Capa Fina
Discriminación de Perfiles Específicos de Ácidos Biliares Fecales
de Hippocamelus antisensis (Cervidae) y Especies Simpátricas Mediante Cromatografía
en Capa Fina
Discrimination of Specific Profiles of Fecal Bile Acid of
Hippocamelus antisensis (Cervidae) and Sympatric
Species Using Thin-
Layer Chromatography
Carla P. López1* , Víctor D. Juarez2
, Víctor D. Juarez2 & Ada V. Cazón2
& Ada V. Cazón2
1Laboratorio de Investigaciones Botánicas (LabIBo). Facultad
de Ciencias Naturales, Universidad Nacional de Salta. Av. Bolivia 5150, (A4408FVL) Salta,
Argentina.
2 Cátedra de Química Orgánica.
Escuela de Biología,
Facultad de Ciencias Naturales, Universidad Nacional de Salta. Av.
Bolivia 5150, (A4408FVL) Salta, Argentina.
Autor corresponsal: lopezcarla987@gmail.com
Resumen
Hippocamelus antisensis “taruca”, es un ciervo
andino sudamericano que habita la cordillera de los Andes desde el sur de Perú hasta La Rioja
en Argentina. Esta especie
es simpátrica con otros cetartiodáctilos, lo que complica la identificación de sus heces mediante métodos organolépticos. Los ácidos biliares
fecales son especie-específicos y pueden caracterizarse por cromatografía en capa fina (TLC).
Este artículo presenta un estudio que tiene como objetivo identificar los patrones de ácidos biliares
fecales de la taruca y otras
especies herbívoras simpátricas mediante TLC, y demostrar que la antigüedad de las heces
no afecta esta identificación. Se analizaron muestras de heces de H. antisensis, Ovis
orientalis aries “oveja” y Lama glama “llama” provenientes de Finca Bárcena (Provincia de Jujuy). Se extrajo 1 g de heces mediante Bz:Me:OH con agitación durante 3 hs., seguido de filtrado y concentración. Cada extracto se sembró en placas
de silicagel con estándares y extractos de heces conocidas. No hubo interferencia de pigmentos dietéticos en los perfiles
de ácidos biliares.
El perfil de H. antisensis se distinguió por la presencia
de ácido deoxicólico, ácido dehydrocólico y el compuesto
X3. Los perfiles de O. orientalis aries y L. glama fueron similares, con la presencia
distintiva de ácido ab2 en L. glama. El índice de similitud de Jaccard entre especies varió de 0.18 a 0.67.
Palabras clave: Ácidos biliares; Llama; Oveja; Taruca; TLC.
Abstract
Hippocamelus antisensis, known as “taruca”,
is a South American Andean deer that inhabits the Andes
mountain range from Southern Peru to La Rioja in Argentina.
This species is sympatric with other
cetartiodactyla, complicating the identification of its feces through organoleptic methods.
Bile acids in feces are species-specific, which could be characterized by thin-layer chromatography (TLC). This article introduces a study that aims to identify the fecal bile acid patterns
of “taruca” and other sympatric herbivores using TLC, and to demonstrate that the age of the feces does not affect
this identification. Extract of feces were obtained from H. antisensis, Ovis orientalis aries
“sheep” and Lama
glama “lama”, belonging to Finca Barcena (Jujuy Province).
A 1-gram sample of feces was extracted
with Bz:Me:OH with agitation
for 3 hours, followed by filtration and concentration. Each extract was seeded in silicagel
plates with standards and fecal extracts of known origin. Interferences from dietary pigments on faecal bile acid profiles were not found. H. antisensis profile was distinguished from the rest by the presence of deoxycholic acid, dehydrocholic acid and an unknown compound
(X3). O. orientalis
aries and L. glama
have shown similar
profiles, but in L. glama
presence of ab2 acid was distinctive. Jaccard
similarity index between species
ranged from 0.18 to 0.67.
 Key words: Bile Acids; Lama; Sheep; Taruca; TLC.
Key words: Bile Acids; Lama; Sheep; Taruca; TLC.
López, C. P, Juárez,
V. D., &
Cazón, A. V. (2024). Discriminación de Perfiles Específicos de Ácidos Biliares Fecales de Hippocamelus antisensis (Cervidae) y Especies
Simpátricas Mediante Cromatografía en Capa Fina. Revista Ciencias Naturales, 2(2), 121–127.
Recibido: 16/12/2023 Aceptado: 28/6/2024 Publicado:
15/8/2024 Editora: Adriana Alvarez
INTRODUCCIÓN
Hippocamelus antisensis (Cetartiodactyla),
conocido como “taruca”, es un ciervo andino
de tamaño mediano, con un peso que oscila
entre 46 y 65 kg y una altura
a los hombros de 69 a 80 cm,
siendo las hembras más pequeñas que los machos; los machos adultos
presentan astas (Herreros
de Lartundo & Sielfeld
Kowald, 2011). El pelaje es largo y grueso,
de coloración gris-arena, con marcas oscuras
en la cara distintivas entre individuos. Se alimentan de pequeñas
plantas disponibles en su hábitat, siendo
exclusivamente herbívoros (Barrio, 2010; Herreros de Lartundo & Sielfeld Kowald, 2011).
La distribución de la especie
está limitada a la Cordillera de los Andes, desde el norte
de Perú hasta el noroeste
de Argentina y el norte
de Chile (Regidor
& Costilla, 2004; Barrio, 2010). En nuestro
país, su ocurrencia se ha citado para las provincias de Jujuy, Salta,
Tucumán, Catamarca y La Rioja (Regidor &
Rosati, 2001). Según Guerra & Pastore
(2019), se estima que en Argentina
existen 2500 individuos maduros de la especie, que enfrentan amenazas como la pérdida y degradación del hábitat, el avance de la
frontera agropecuaria y ganadera, como así
también el aumento de la urbanización, el desarrollo de la actividad minera y la caza.
Según la Unión Internacional para la Conservación de la Naturaleza (IUCN), la taruca se encuentra en la categoría
de Vulnerable (Barrio et al., 2017). Asimismo,
la Convención sobre el Comercio Internacional de Especies Amenazadas de Fauna y Flora
Silvestre (CITES) la incluye en el Apéndice
I (Barrio & Ferreyra,
2008), y a nivel nacional es considerada En Peligro
(Res. SAyDS 1030/04; Guerra & Pastore, 2019). Desde
1996, la taruca posee la máxima
categoría de conservación como Monumento
Natural Nacional a través
de la Ley 24.702. En términos de la Ley 22.351, se recomienda a la Administración de Parques Nacionales diagramar e implementar un plan de manejo
para la especie, siendo necesario el estudio de su distribución y abundancia (Regidor
& Costilla, 2004;
Guerra & Pastore, 2019).
En términos de estudios de poblaciones,
las metodologías utilizadas tradicionalmente para caracterizar las especies silvestres se basan en capturas
(Pérez Vargas &
Fuentes, 2008), encuentros directos (Núñez & Tarifa,
2006), entrevistas a pobladores locales y evidencias indirectas de su presencia
(Regidor & Costilla,
2004). Identificar las heces en el
campo es fundamental para la confirmación de la presencia de especies en áreas determinadas. El reconocimiento puede realizarse con base en las características
externas de las heces, como el tamaño y la forma,
entre otras (Fernández et al., 1997). Sin embargo, en
algunas ocasiones puede ser engorroso debido a los efectos
de las condiciones ambientales
y a
los procesos degradativos a los que están
expuestas, más aún cuando cohabitan
con especies con las que pueden ser confundidas (Khorozyan et al., 2007; Cazón
Narvaéz et al., 2009) como cabras, ovejas y guanacos (Guerra & Pastore, 2019).
La identificación de las heces a través del perfil de ácidos biliares ha sido propuesta como una técnica útil, debido a que los ácidos biliares fecales y sus concentraciones relativas son diferentes entre las especies, generando un patrón único
mediante la técnica bioquímica de Cromatografía en Capa Fina (TLC) (Major et al., 1980; Fernández
et al., 1997; Cazón Narvaéz & Sühring, 1999). En
mamíferos, la TLC de ácidos biliares ha sido
utilizada para la identificación de heces de
especies del orden Carnívora (Major
et al., 1980; Fernández
et al., 1997; Cazón Narvaéz &
Sühring, 1999; Khorozyan
et al., 2007), de omnívoros del orden Xenarthra (Araujo
et al., 2010; Casanave
et al., 2012) y en herbívoros del orden Artiodactyla (Cazón Narvaéz & Juárez, 2014). Sin embargo, también
se ha documentado la incidencia de pigmentos producto de la dieta en la lectura de ácidos
biliares fecales (Quinn &
Jackman, 1994; Jiménez & Jaksic, 1996). En este trabajo se propone utilizar la TLC para extraer e identificar ácidos biliares fecales presentes en heces de H. antisensis, Ovis orientalis aries y
Lama glama, y con base en ello responder los siguientes interrogantes: 1) ¿Es posible aplicar la técnica de TLC para identificar ácidos biliares fecales en las especies bajo estudio,
considerando su tipo de dieta? 2) ¿Afecta la antigüedad de las heces a la presencia y concentración de los ácidos
biliares fecales? 3) ¿Es efectiva la TLC para generar un patrón de ácidos biliares de Hippocamelus antisensis que permita discriminar sus heces de las especies simpátricas analizadas en este trabajo?
MATERIALES
Y MÉTODOS
La recolección de muestras se llevó a cabo en dos áreas (de ahora en más, A1 y A2) pertenecientes a la Finca Bárcena, ubicada en la localidad de Volcán,
Provincia de Jujuy (23º 54’ 060” O, 65º 29’ 655”). Ambas áreas corresponden a
la Provincia Fitogeográfica de la Prepuna, con una altitud entre 2000 y 3400 m
snm (Fig. 1).
Se recolectaron un
total de 49 muestras de heces los días 24, 25 y 26 de mayo de 2012. En el área
A1 se obtuvieron 20 muestras de H. antisensis, mientras que en el área
A2 se
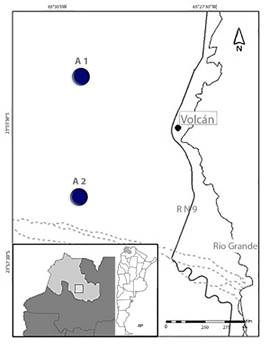
Figura 1. Areas de muestreo, A1 y A2, en la provincia de Jujuy (Argentina).
recolectaron 23 muestras de H. antisensis, tres de O. aries y
tres de L. glama. La identificación de las heces se realizó con base a
características físicas y organolépticas. Las muestras de ganado se recogieron
directamente de los corrales y fueron colectadas con guantes de látex y
depositadas en bolsas de papel. Se registró el estado de meteorización o
invasión por hongos y se clasificaron como frescas o secas. Además, se realizó
un registro fotográfico de los bosteaderos.
En el laboratorio, se utilizó el método desarrollado
por Cazón Narvaéz & Sühring (1999). El patrón de ácidos biliares de cada
especie se determinó comparando los valores del factor de retención Rf
(relación entre la distancia recorrida por el compuesto y la distancia
recorrida por el frente del solvente), así como el color e intensidad
(concentración) de cada compuesto con los correspondientes a los ácidos
biliares estándares utilizados como referencia. El Rf mide la
capacidad de migración relativa de un compuesto en la placa cromatográfica en
función de la solubilidad de cada ácido biliar.
Los compuestos orgánicos con valores de Rf
mayores que el del colesterol fueron descartados como ácidos biliares, pero se
consideraron en la descripción de los patrones cromatográficos. La similitud en
la composición de ácidos biliares entre las especies se evaluó a través del
Índice de Jaccard utilizando el software Infostat. Los valores de este índice
oscilan entre 0 (sin similitud) y 1 (total similitud).
RESULTADOS
En el 90% de las placas
cromatográficas, los ácidos biliares estándares se desarrollaron correctamente, las bandas tomaron
el color característico y alcanzaron los valores de Rf que los definen,
por lo que se logró reconocer
efectivamente los compuestos
específicos (Tabla 1), a excepción
de los ácidos dehidrocólico y litocólico, que mostraron
colores de baja intensidad. También se
desarrollaron y revelaron en las placas
dos ácidos biliares no identificados ab1 con
|
Estándares
|
Color
|
Media ± E.E
|
|
Colesterol
|
Violeta oscuro
|
0.66 ± 0.03
|
|
Ácido cólico
|
Marrón
|
0.24 ± 0.06
|
|
Ácido dehidrocólico
|
Naranja
|
0.34 ± 0.01
|
|
Ácido deoxicólico
|
Verde-marrón
|
0.41 ± 0.05
|
|
Ácido glicólico
|
Violeta
|
0.19 ± 0.03
|
|
Ácido litocólico
|
Gris
|
0.54 ± 0.05
|
|
Ácido quenodeoxicólico
|
Azul
|
0.34 ± 0.03
|
|
Ácido taurodeoxicólico
|
-
|
0 ± 0
|
|
Ácido ursodeoxicólico
|
Azúl
|
0.45 ± 0.03
|
Tabla 1. Intervalo de confianza, media (± E.E) de los valores de Rf
de los ácidos biliares y los
Rf =0.28 y ab2 con Rf= 0.34
y compuestos no identificados como ácidos biliares, con Rf mayores al colesterol (X1 con
Rf=0.68, X2 con Rf=0.78, X3 con Rf=0.92 y X4 con Rf=0.97).
El color de los extractos fue pardo verdoso. La presencia de pigmentos que se
visualizaron con luz ultravioleta en las placas cromatográficas recién
desarrolladas y sin revelar, fueron marcados y se descartaron en el revelado y
análisis de las placas. No se encontró diferencias en la presencia y concentración
de ácidos biliares fecales, entre los grupos de muestras frescas y secas en
ambas áreas de estudio y en las tres especies estudiadas.
El patrón de ácidos biliares
fecales para las especies estudiadas, se describen en la Tabla 2. Todas las
especies presentaron colesterol, ácido litocólico, ácido cólico, el ácido ab1 y
los compuestos X1, X2 y X4. El perfil de H. antisensis se distinguió del
resto
|
Ácidos biliares, Coles- terol y compuestos no identificados (ab)
|
Hippocamelus
antisensis
N=43
|
Lama glama
N=3
|
Ovis orientalis aries
N=3
|
|
X4
|
0.97±0.02 (xx)
|
0.97±0.02 (x)
|
0.97±0.02 (x)
|
|
X3
|
0.92±0.03 (xx)
|
-
|
-
|
|
X2
|
0.78±0.02 (xx)
|
0.78±0.01 (x)
|
0.78±0.01 (x)
|
|
X1
|
0.68±0.01 (xx)
|
0.67±0.01 (x)
|
0.67±0.01 (x)
|
|
Colesterol (violeta)
|
0.66 ± 0.03
(xxx)
|
0.66±0.02 (xxx)
|
0.66±0.02 (xxx)
|
|
Ácido litocólico (azul-violáceo)
|
0.54 ± 0.05
(xx)
|
0.55±0.04(xx)
|
0.55±0.04(xx)
|
|
Ácido
deoxicólico (verde-marrón)
|
0.41 ± 0.05
(xx)
|
-
|
-
|
|
Ácido dehydrocólico (anaranjado)
|
0.34 ± 0.01
(x)
|
-
|
-
|
|
Ab1 (marrón)
|
0.34 ± 0.01
(x)
|
0.34 ± 0.01
(x)
|
0.34 ± 0.01
(x)
|
Tabla 2. Ácidos biliares
presentes en las heces de H. antisensis, O. aries y L. glama. La
concentración baja (x), media (xx) y alta (xxx) fueron determinadas por estimaciones visuales de la intensidad del color del compuesto esteroide
con respecto a los estándares. Se incluyen al ácido biliar no identificado (ab1 y ab2) y los
compuestos con Rf mayores al colesterol (X1, X2, X3 y X4).
por la presencia de ácido
deoxicólico, ácido dehydrocólico y el compuesto X3. Los perfiles de O.
orientalis aries y L. glama fueron similares entre ellos, con la
excepción de la presencia del ácido ab2 en L. glama.
El índice
de Jaccard para las comparaciones entre las tres especies bajo estudio, varió
entre 0.18 y 0.67. Se encontró que el patrón de ácidos biliares fecales de H.
antisensis posee bajo grado de similitud con O aries y L. glama,
con valor 0.18. El mayor grado de similitud resultó entre O. orientalis
aries y L. glama (0.67).
DISCUSIÓN
En este trabajo, logramos
a través de la TLC extraer e identificar los ácidos biliares
fecales de las especies Hippocamelus antisensis, Ovis
orientalis aries y Lama glama bajo estudio. La técnica de cromatografía en capa fina supone
ser sencilla y fácil para el operador
(Cazón Narvaéz & Sühring,
1999), aunque requiere como cualquier técnica
de laboratorio, conocimientos teóricos
y habilidades prác- ticas (Khorozyan et al., 2007; Araujo et al., 2010). Para la identificación de los ácidos biliares fecales se requirió observación rigurosa de las bandas en las placas, registro
de color, intensidad y Rf, necesarios para la
determinación de los patrones
de cada especie.
Las diferencias de color de los extractos entre las especies,
según sean carnívoras, omnívoras o herbívoras, pueden manifestar
composición de la dieta, principalmente debido a los pigmentos
de plantas (Araujo et al., 2010). Las especies con las que se trabajó
son herbívoras, lo que justifica
el color pardo verdoso de los extractos, debido a la presencia
de pigmentos. Se encontraron pequeños
restos de plantas sin digerir, que fueron procesados
con tamiz. Algunos autores han documentado
que el alto nivel de pigmentos
en las heces afecta la detectabilidad de los ácidos biliares con TLC (Quinn & Jackman, 1994; Picton & Kendall, 1994; Rödel
et al., 2001), sugiriendo
que la técnica no debe usarse para especies
que se alimenten de plantas (Fernández
et al., 1997, Capurro
et al., 1997). En nuestra experiencia a pesar de su presencia,
los pigmentos de plantas
no interfirieron en el
análisis, ya que éstos se visualizaron con luz
ultravioleta en las placas cromatográficas recién desarrolladas y sin revelar, luego se marcaron y se descartaron en el
revelado. De ésta manera fue posible identificar las bandas de ácidos biliares por el color y el característico, como se ha propuesto
para especies herbívoras (Cazón Narvaéz & Juárez,
2014) y omnívoras (Araujo et
al., 2010). Recomendamos nuevos acercamientos para evaluar la posible variabilidad que pudiera existir en el perfil de ácidos biliares
fecales, teniendo en cuenta que la técnica TLC utilizada, fue puesta a punto para carnívoros (Cazón Narvaéz & Sühring, 1999).
Se sabe que los ácidos biliares
son moléculas estables (Lin et al., 1978) y también
solubles, por lo que se ha sugerido que el tiempo de exposición en la naturaleza, dificulta el uso de la TLC de ácidos biliares
fecales (Fernández et al., 1997, Khorozyan et al., 2007). Sin embargo, Picton & Kendall (1994) han demostrado en el estudio
de Ursus americanus
y Ursus arctos, que la antigüedad de las heces no tuvo incidencias en la discriminación por TLC de ácidos
biliares fecales. A partir de las heces de H. antisensis, O. orientalis aries y L. glama colectadas en la Provincia
de Jujuy, se han detallado
observaciones de muestras que presentaban
rasgos con alto grado de meteorización y muy antiguas, que sin embargo no revelaron
diferencias significativas en la presencia
y concentraciones de ácidos biliares fecales con muestras frescas. Esto podría atribuirse al clima seco del área de estudio,
que evitaría la dilución de los compuestos químicos
presentes en las heces (Capurro et al., 1997).
La TLC de ácidos
biliares fecales demostró ser eficaz para discriminar las heces de H. antisensis, O. orientalis aries y L. glama. La
aplicación de la técnica
es muy valiosa y útil para
éstas especies simpátricas, ya que las heces suelen confundirse en la naturaleza por el parecido en las características externas. El perfil de H. antisensis se distinguió del resto
por la presencia de ácido
deoxicólico, ácido
dehydrocólico y el compuesto X3. Los perfiles de O. orientalis aries
y L. glama fueron similares entre ellos, en L. glama fue distintivo la presencia del ácido ab2. La presencia y concentraciones de ácidos
biliares en cada una de las muestras de heces, no mostraron variaciones
entre individuos ni entre áreas
de estudio, tal y como lo han propuesto diversos autores
(Major et al., 1980; Fernández
et al., 1997;
Khorozyan et al., 2007; Araujo et al., 2010). El índice de similitud de Jaccard demostró
la distancia que existe
entre los patrones
de las especies bajo estudio,
que evidencia la especificidad del perfil
de ácidos biliares
fecales obtenidos por TLC (Guerrero et al., 2006).
Proponemos los resultados obtenidos
a través de la TLC de ácidos biliares fecales para futuros estudios, ya que consideramos que ofrece un método preciso y no invasivo para identificar la presencia
de H. antisensis, superando las limitaciones de los métodos tradicionales basados en observaciones
directas y características
físicas de las heces.
La aplicación de TLC en estudios de H. antisensis
es particularmente valiosa debido a la naturaleza esquiva de ésta especie y su estado de conservación crítico.
Con una población estimada
de solo 2500 individuos
maduros en Argentina,
cualquier herramienta que mejore la precisión
del monitoreo de su población y distribución es crucial. Los resultados obtenidos pueden facilitar la identificación de áreas claves de hábitat,
permitiendo focalizar regiones prioritarias y
adoptar medidas específicas para proteger
estos entornos. También, podría contribuir a evaluar
el impacto de factores
antropogénicos, como la actividad minera y el desarrollo
agrícola, en su supervivencia.
En resumen,
la implementación de la TLC en estudios de H. antisensis no solo mejora la precisión en la identificación y monitoreo de esta especie, sino que también ofrece
una herramienta robusta para la
investigación de su ecología, estrategias de manejo y conservación más efectivas, contribuyendo a la preservación de una especie emblemática y en peligro de extinción.
AGRADECIMIENTOS
Agradecemos a la Familia Bárcena por la
autorización para llevar a cabo el estudio en su finca. A Pablo Ortega Baes por la revisión crítica del manuscrito. Al CIUNSA por el
financiamiento. A Ivana Guerra por el soporte de campaña.
REFERENCIAS
Araujo, M. S., Ciuccio, M., Cazon, A. V, &
Casanave, E. B. (2010). Differentiation of Xenarthra (Mammalia) species
through the identification of their fecal bile acid patterns:
An ecological tool. Revista Chilena
de Historia Natural, 83, 557-566. https://dx.doi. org/10.4067/S0716-078X2010000400009
Barrio, J., &
Ferreyra, N. (2008).
Hippocamelus antisensis. The IUCN Red List of
Threatened Species 2008: e.T10053A3156943. http:// dx.doi.org/10.2305/IUCN.UK.2008.RLTS.T10053A3156943.en
Barrio, J. (2010). TARUKA Hippocamelus antisensis (d’Orbigny 1834). En J. M. B. Duarte
& S. Gonzalez, (Eds.).
Neotropical cervidology:
biology and medicine of Neotropical
deer (pp.77-88). FUNEP y IUCN.
Barrio, J., Núñez A., Pacheco,
L., Regidor, H.A., & Fuentes-Allende, N. (2017). Hippocamelus antisensis. The IUCN Red
List of Threatened Species 2017: e.T10053A22158621. http:// dx.doi.org/10.2305/IUCN.UK.2017-2.RLTS.T10053A22158621.en
Capurro, A. F., Novaro, A. J., Travaini, A., &
Romero, M. S. (1997). Improved bile-acid thin-layer chromatography to identify
feces of neotropical carnivores. The Journal of wildlife management, 61, 1424-1427.
https:// doi.org/10.2307/3802146
Casanave, E. B., Araujo, M. S., & López, G. H.
(2012). Use of chromatography in animal
ecology. Chromatography–The most versatile
method of chemical analysis. https://doi.
org/10.5772/48669
Cazón Narváez, A. V., & Sühring,
S. S. (1999). A technique
for extraction and Thin Layer Chromatography
visualization of fecal bile acids applied to
neotropical felid scats. Revista de Biología Tropical, 47, 245-249.
https://doi.org/10.15517/rbt.v47i1-2.33042
Cazón Narváez, A. V., Juárez, V. D., Monjeau,
J. A., & Lilienfeld, M. (2009). Discriminación de heces de puma (Puma concolor) y jaguar (Panthera onca)
por identificación de sus ácidos biliares: una técnica para el monitoreo
de carnívoros silvestres. Mastozoología Neotropical, 16, 449-453.
Cazón Narváez, A. V., & Juárez V. D. (2014)
Identificación de mamíferos silvestres y confirmación de su presencia, por cromatografía en capa fina (TLC) de sus ácidos biliares. COMFAUNA Memorias del X Congreso Internacional de
Fauna Silvestre de América Latina,
Salta, Argentina.
Fernández, G. J., Corley, J. C., & Capurro,
A. F. (1997). Identification of cougar
and jaguar feces through bile acid chromatography. The Journal of wild life management, 506-510.
https://doi.org/10.2307/3802608
Guerra, Ivana C.; Pastore, Hernán (2019). Hippocamelus antisensis. En: SAyDS–SAREM (Eds.) Categorización 2019 de los mamíferos de Argentina
según su riesgo de
extinción. Lista Roja de los mamíferos de Argentina. http://cma.sarem.org.ar.
Guerrero, C., Espinoza, L.,
Niemeyer, H. M., & Simonetti, J. A. (2006). Using fecal profiles of bile acids to assess habitat use by threatened carnivores in the Maulino
forest of central Chile. Revista
Chilena de Historia Natural, 79, 89-95. http://dx.doi.org/10.4067/S0716-078X2006000100008
Herreros de Lartundo, J., & W. Sielfeld
Kowald. (2011). La Taruca,
Huemul del norte (1ª
Ed.). Ministerio del Medio Ambiente.
Arica, Chile. https://educacion.mma.gob. cl/wpcontent/uploads/2015/09/LaTaruca_ HuemulDelNorte.pdf
Jiménez,
J. E., & Jaksic, F. M. (1996). Inability of thin-layer chromatography to
distinguish feces from congeneric foxes by their bile acid contents. Acta
Theriologica, 41, 211-216. https://doi.org/10.4098/AT.arch.96-21
Khorozyan,
I. G., Cazón, A., Maljhasyan, A. G., & Abramov, A. V. (2007). Using
thin-layer chromatography of fecal bile acids to study the leopard (Panthera
pardus ciscaucasica) population. Biology Bulletin, 34, 361-366. https://doi.org/10.1134/S1062359007040085
Lin,
D. S., Connor, W. E., Napton, L. K., & Heizer, R. F. (1978). The steroids
of 2000-year-old human coprolites. Journal of Lipid Research, 19,
215-221. https://doi. org/10.1016/S0022-2275(20)41560-3
Major,
M., Johnson, M. K., Davis, W. S., & Kellogg, T. F (1980). Identifying
scats by recovery of bile acids. The Journal of Wildlife Management,
290-293. https://doi. org/10.2307/3808391
Núñez,
A., & Tarifa, T. (2006). Tamaño de grupo, estructura de edad y proporción
de sexos de una población de taruca (Hippocamelus antisensis d’Orbigny,
1834) en el cantón Lambate, Departamento de La Paz, Bolivia. Ecología en
Bolivia, 41, 171-177.
Pérez Vargas,
J., & Fuentes, N. (2008). Diagnóstico
Poblacional del Guanaco y Taruca en la Provincia de Parinacota. Código BIP 20193099-0. Departamento de Medio Ambiente y Áreas Protegidas. Corporación Nacional. Forestal Región de Arica y Parinacota. Chile.
Picton, H. D., &
Kendall, K. C. (1994). Chromatographic
(TLC) differentiation of grizzly bear and
black bear scats. Bears: Their Biology
and Management, 497-501. https://doi.org/10.2307/3872737
Quinn, T., & Jackman, W. R. (1994). Influence of diet on detection of fecal bile acids by thin-layer chromatography. The Journal of Wildlife Management, 295-299. https://doi. org/10.2307/3809394
Regidor, H. A., & Rosati, V. A (2001). Taruca. Los ciervos autóctonos de la Argentina y la
acción del hombre.
Secretaría de Desarrollo Sustentable y Política Ambiental (pp. 75-82). Ministerio de Desarrollo Social y Medio Ambiente, Buenos
Aires.
Regidor, H.A. & Costilla, M. (2004).
Un mapa de distribución para la taruca
Hippocamelus antisensis en el Noroeste Argentino. IV Congreso internacional de manejo de fauna
silvestre en la Amazonia
y Latinoamérica, 34.
Rödel, H. G., H. Ebersbach
& M. Stubbe 1998. Feeding ecology of the stone marten (Martes
foina): the importance of mammalian prey.
Beiträge zur Jagdund Wildforschung, 23, 219-230.
Discriminación de Perfiles Específicos de Ácidos Biliares Fecales
de Hippocamelus antisensis (Cervidae) y Especies Simpátricas Mediante Cromatografía
en Capa Fina
, Víctor D. Juarez2
& Ada V. Cazón2
Key words: Bile Acids; Lama; Sheep; Taruca; TLC.