
Estudio
fisiológico de Canna indica
(Cannaceae), una Fuente Alimenticia, en Medios de Cultivo
no Convencionales
Physiological Study of Canna indica (Cannaceae), a Food Source
for the non conventional
Cultivation
Marcelo P. Hernández2, 3, 4, 6*  , Marcela F. Ruscitti1, 2, 5
, Marcela F. Ruscitti1, 2, 5 , Felipe S. Calonge2
, Felipe S. Calonge2 , Alejanda V. Carbone1, 2
, Alejanda V. Carbone1, 2 & Jorge E. Bueno Prieto6
& Jorge E. Bueno Prieto6 
1
Instituto de Fisiología Vegetal (INFIVE-CONICET). 2 Facultad de Ciencias Agrarias
y Forestales (FCAyF),
Universidad Nacional de La Plata (UNLP), calle 60 entre 116 y 119, (1900) La Plata, Buenos Aires, Argentina. 3 Facultad de Ciencias Naturales
y Museo (FCNyM-UNLP), calle 60 y 122, (1900) La Plata, Buenos Aires, Argentina. 4 Museo de Ciencias
Naturales (UNLP), Paseo del Bosque s. n. (1900) La Plata, Buenos Aires, Argentina. 5 Departamento de Ciencias Básicas y Experimentales, Universidad Nacional del Noroeste
de la Provincia de Buenos Aires (UNNOBA),
(6000) Junín, Buenos Aires,
Argentina. 6 Instituto de Astrobiología de Colombia
(IAC), Calle 93 B, N° 18-12, (110221) Bogotá, Colombia.
*marcelo.hernandez@agro.unlp.edu.ar
Resumen
Canna indica, originaria de América tropical, es una hierba perenne y rizomatosa con gran valor nutricional,
medicinal (rizomas), forrajera
(rizomas y follaje
molidos) y ornamental. Nuestro objetivo
fue hallar un sustrato óptimo para el cultivo de esta especie,
con fines alimenticios, en condiciones no aptas
para un cultivo convencional. Las plantas se cultivaron en un invernáculo, entre los meses de septiembre y diciembre del año 2018,
en macetas de 13,5 L, utilizando diferentes sustratos: arena,
hidroponía en solución de Hoagland
perlita, tierra
y vermiculita. En cada maceta
se colocaron dos fragmentos de rizoma de 10 x 3,0-4,0 cm, con tres repeticiones por tratamiento. Se evaluaron
los siguientes parámetros: altura alcanzada de la parte aérea (tallo, hoja, inflorescencia y fruto); área foliar; peso fresco y peso seco de la parte subterránea (raíz y rizoma)
y de la parte aérea (tallo, hoja, inflorescencia e infrutescencia); clorofila
a, b, total y carotenos (tallo y hojas);
albúminas (rizomas); y densidad de granos de almidón (rizomas). Los resultados se analizaron mediante
el software Statistica 7.0. Al finalizar
el ensayo, las plantas que lograron
un mayor crecimiento, con formación de frutos maduros,
fueron las cultivadas en los sustratos hidroponía en solución
y vermiculita.
Palabras clave: Almidón, Ambientes extremos; Canna indica; Hidroponía; Planta alimenticia
Abstract
Canna indica is a perennial and rhizomatous herb,
native to tropical
America. It has great
nutritional value, with edible rhizomes
which are rich in fiber, and also possessing amylase and shoots, which are rich in protein. Likewise, it has medicinal (rhizomes), forage (ground rhizomes
and foliage) and ornamental importance. Our objective was to find an optimal
substrate for the cultivation of this species,
for food purposes, in conditions not suitable
for conventional cultivation. The plants were grown in a greenhouse, between the months of September and December,
2018, in 13.5 L pots, using the following substrates: sand, hydroponics solution (Hoagland), perlite, soil and vermiculite. Two rhizome fragments
of 10 x 3.0-
4.0 cm were placed in each substrate
type, with three repetitions per treatment. The following parameters
were evaluated: periodic
increase in height of the aerial part (stem, leaf, inflorescence and
fruit); leaf area; fresh weight and dry weight of the underground part (root and rhizome), and the aerial part (stem, leaf, inflorescence and infructescence); total chlorophyll a, b, and carotenes (stem and leaves);
albumins; and density of starch grains (rhizomes). The results were analyzed using Statistica 7.0 software.
At the end of the test, the plants with the greatest
growth, with the formation
of mature fruits, were those grown in the hydroponics substrates in solution
and vermiculite.
Keywords: Canna indica; Extreme environments; Food plant; Hydroponics, Starch

Hernández, M. P., Ruscitti M. F., Calonge F. S., Alejanda. Carbone, V., & Bueno Prieto J. E. (2024). Estudio Fisiológico de Canna
indica (Cannaceae), una
Fuente Alimenticia, en Medios de Cultivo no Convencionales. Revista Ciencias
Naturales, 2(1), 22–35.
Recibido: 2/10/2023 Aceptado:
13/3/2024 Publicado: 15/3/2024 Editora:
Ana Zelarayán
INTRODUCCIÓN
Canna indica L. “achira” (Cannaceae) es una hierba
terrestre, hidrófila y rizomatosa,
de hasta 2 m de altura,
originaria de América tropical
(México, Las Antillas, Centro
y Sudamérica hasta la Argentina). Su domesticación se extendió
desde Colombia a lo largo de Los Andes hasta
Perú, siendo utilizada por los Incas 5.700 años atrás. Actualmente se cultiva
en algunos lugares
de Colombia y Asia como fuente alimenticia (Pochetino, 2015), por su gran valor nutricional. Sus rizomas
contienen un 75 % de agua y un alto contenido
de fibras (Barrera et al., 2004). Popenoe et al. (1990), mencionan que la materia
seca del rizoma, presenta un 75-80 % de almidón,
6-14 % de azúcar (principalmente
glucosa y sacarosa), 1-3 %
de proteínas y un alto contenido de potasio, y 10 % de proteínas, en sus hojas y brotes.
Los brotes se consumen
como vegetales verdes
(Popenoe et al., 1990). Los rizomas ricos
en almidón, se consumen
hervidos, a las brasas o fritos (Rapoport
et al., 2009). Su harina sirve para la fabricación de bizcochos, bizcochuelos, colaciones (harina más queso),
fideos, galletas, panes, pastas
comestibles, tortas, etc. (Martínez Crovetto, 1981; Espinosa et al.,
1997; Rapoport et al., 2009). Es
importante destacar que el almidón de esta planta posee un alto contenido
de amilosa (Yaruro Cáceres et al., 2021).
En famacología esta especie
constituye un agente nutricional infantil, siendo además, antibacteriano, antiabortivo, antialérgico, an- ticancerígeno, antihemorrágico nasal,
antima- lárico,
antiséptico, antioxidante, astringente, contra úlceras, contra
ictericia aguda, diges- tivo, diurético y emoliente (Martínez
Crove- tto, 1981; Romero Vásquez & Valdez Valles, 2016; Cañar Inga & Paguay Verdugo, 2017). En
medicina tradicional, la decocción de los
rizomas, en tomas, tiene efecto abortivo, an- tiasmático, antiblenorrágico, antinefrítico, antirreumático, diurético, emenagogo
y emo- liente (Martínez
Crovetto, 1981, Marzocca, 1993; Hernández et
al., 2010).
Los rizomas y follaje
molidos son utilizados como alimento para el ganado
(Popenoe et al., 1990). Por su porte y elegancia, se cultiva
como planta ornamental (Hurrell et al., 2005), utilizada como cerco vivo y como cortina
protectora de viento (Popenoe et
al., 1990).
Gómez (2016), menciona que la existencia de vida tal como la conocemos, basada en carbono, dependerá
de los rangos de los parámetros físico-químicos ambientales
que sea capaz de soportar,
es decir, a los límites que le impone
el carbono y, más concretamente, los que le imponen los enlaces
covalentes que el carbono establece consigo
mismo o con otros elementos que forman parte
de los sistemas vivos. De esta manera, un ambiente
natural extremo,
es aquel caracterizado por una o varias condiciones físico-químicas hostiles para el desarrollo de la vida. En este contexto, se han hallado organismos criófilos (a -12 ºC), termófilos (entre los 121 ºC y los
130 ºC), acidófilos, alcalófilos, barófilos, xerófilos y resistentes a elvadas radiaciones (Gómez, 2016). Según MacElroy
(1974), los organismos que habitan estos
ambientes extremos se denominan “extremófilos“. Algunas poblaciones humanas viven en ambientes
terrestres extremos,
tales como: la Localidad Tolar Grande (Grau et al., 2018) y la Base Antártica Belgrano
II (Tortello, 2020), en Argentina, y el Desierto de la Tatacoa en Colombia (Rendón, 2012; Bueno Prieto &
Martínez Frías, 2021).
La localidad de Tolar Grande,
se sitúa en la provincia de Salta, entre los 3.700 y 4000 m s.m. en un desierto de altura denominado “Puna Seca” (Grau et al., 2019; Hernández et al., 2019; Hernández et al., 2020). Presenta
suelo muy pobre en materia orgánica, arenoso-
pedregoso, con alto
contenido de sales solubles y arcillas con capas de yeso superficial. Su clima es frío y seco, con temperatura mínima en invierno de hasta -15ºC, y en verano, con máximas promedio
de 15ºC y mínimas por debajo de los 0ºC. (Cabrera, 1976; Hernández et al., 2019).
La Base Antártica Belgrano
II, situada al S del mar de Weddell, en el nunatak
Bertraben la costa Confín, Tierra de Coats, en los 77º 51’
S y
34º 33’ O, es la estación permanente argentina más austral. Esta zona, en ocasiones azotada
por vientos superiores a 200 Km/h, presentan un suelo cubierto por nieve, con temperatura máxima
-2ºC y la mínima -54ºC.
El Desierto
de La Tatacoa, situado en el departamento del Huila a 440 m s.n., está constituido
por dos ecosistemas Bosque Seco Tropical
y Bosque Muy Seco Tropical, con suelo de origen ígneo y sedimentario, y temperatura promedio
entre 28°C y 40°C
(Figueroa Cardozo & Galeano, 2004; Florez- Molina, et al. 2018). A pesar
de las condiciones extremas de su ecositema,
la presencia de poblaciones humanas son
históricas, teniendo registros previos a la conquista
en 1492 (Monje, 2001).
Estos lugares presentan algunas caracte-
rísticas análogas a algunas superficies extra- terrestres (Bueno Prieto & Martínez Frías, 2021). También la Estación Espacial Interna-
cional (EEI), tiene
condiciones ambientales extremas, donde el cultivo
de plantas cumple un
rol fundamental para la supervivencia de sus habitantes (Medina,
2020).
La creciente demanda de alimentos ha ocasionado que la agricultura sea introducida en ecosistemas
frágiles, propensos a la degradación y contaminación, con la consiguiente disminución de la
productividad (Chavarría-Torrez &
Castillo-Castro, 2018). Un
cultivo tradicional constituye la forma frecuente de hacer agricultura, donde las plantas crecen
en un suelo provisto de elementos nutritivos, a diferencia
de un cultivo no tradicional, como por ejemplo
la hidroponía en la cual las plantas crecen
en soluciones nutritivas o en sustratos donde se le aportan
los nutrientes en cantidades adecuadas, lo que
conlleva al desarrollo de cultivos sanos en espacios relativamente menores en comparación con la agricultura tradicional
(Antillón, 2004; Beltrano & Giménez, 2015).
En la actualidad, existen nuevas alternativas para la producción
de plantas, una de estas es la hidroponía, que utiliza un
sustrato estéril, inorgánico y controlado, eliminando la necesidad del suelo, reduce la erosión, el desgaste por fertilizantes y productos fitosanitarios. Además disminuye la incidencia de enfermedades radiculares de las plantas (Beltrano & Giménez,
2015).
La hidroponía ha sido empleada
por muchas compañías petroleras y mineras
que trabajan en lugares
remotos e inhóspitos, en donde la agricultura tradicional no permitiría garantizar la producción de vegetales para
su personal. De esta manera se conocen emprendimientos de esta clase en el Lejano Oriente,
en el desierto de Sahara, en la Antártida, e incluso, fuera de nuestro
planeta. Asi en la década del 80, la Administración Nacional de Aeronáutica y el Espacio
(NASA) realizó diversas investigaciones en el tema con la dirección del reconocido fisiólogo Fran Salisbury (Beltrano
& Giménez,
2015); también las plantas han demostrado la potencialidad y habilidad de crecer
y reproducirse en vehículos espaciales y en la EEI (Cowles,
1989; Ivanova et al.,1993; Paradiso
et al., 2014; Ruyters & Braun, 2014; Jost et al., 2015; Musgrave, 2007), siendo componente importante de los sistemas
de soporte vital.
Las propiedades nutricionales de C. indica la convierten en una de las plantas alimenticias que podrían cultivarse en ambientes extremos en la superficie terrestre u otra semejante.
El objetivo de este trabajo fue hallar un sustrato óptimo
para el cultivo de C. indica, en condiciones no aptas para un cultivo convencional.
MATERIALES Y MÉTODOS
Durante el mes de agosto del año 2018, se obtuvieron manualmente 30 fragmentos de rizomas de C. indica situados en el Jardín Botánico y Arboretum
“Carlos Spegazzini” de la Facultad de Ciencias Agrarias y
Forestales (UNLP); asimismo, la parte aérea de los rizomas
fue herborizada y depositada
en el herbario LPAG (Thiers,
2023) de la Facultad de Ciencias Agrarias
y Forestales de la Universidad Nacional de la Plata con los siguientes datos:
Canna indica
L. ARGENTINA. Prov. Buenos
Aires, Pdo. La Plata, La Plata, Jardín Botánico y Arboretum
“C. Spegazzini”, 20-09-2018, Hernández M. P.
170 ,171, 172, 173 (LPAG).
Fragmentos de rizomas
fueron cultivados entre los meses de septiembre a diciembre de 2018 en el invernáculo del Instituto de Fisiología Vegetal
(INFIVE-UNLP), en condiciones
semicontroladas de temperatura por ventilación forzada
(20°-35°C) y con fotoperíodo natural para las coordenadas:
S34°54´45,17´´W57°55´52, 87´´.
Se utilizaron 15 macetas de 13,5 L con los siguientes tratamientos: hidroponía en solución
con sistema de aireación, perlita, vermiculita, arena y tierra.
En cada maceta
se colocaron dos fragmentos de rizoma de 10 X 3-4 cm, con
tres repeticiones por tratamiento.
Para el tratamiento hidroponía en solución
se utilizó solución de Hoagland (Hoagland
& Arnon, 1938) que fue renovada
cada 15 días. Los sustratos
perlita, vermiculita y arena, se regaron
con solución de Hoagland; el sustrato
tierra (tratamiento testigo)
se regó con agua destilada. En todos los casos las macetas
fueron regadas cada 48 hs. Finalizado el ensayo, 100 días después
(Fig. 1), se evaluaron
los siguientes parámetros:
a.
Altura final alcanzada de la parte aérea
(tallo, hoja, inflorescencia y fruto),
mediante uso de cinta
métrica.
b.
Área foliar (AF) determinada
con el medidor Licor Li-3000.
c.
Peso fresco
de la parte subterránea “raíz- rizoma” (PFR), peso fresco de la hoja (PFH) y
peso fesco de tallo-flor-fruto (PFT). El material fresco se pesó utilizando una balanza gravimétrica.
d.
Peso seco de la parte subterránea “raíz y rizoma” (PSR), peso seco de la hoja (PSH) y
peso seco de tallo-flor-fruto (PST). El material
se colocó en una estufa a 72ºC durante
4 días hasta lograr un peso constante; se utilizó una balanza gravimétrica.
e.
Clorofila a, b, total y contenido de caro- tenoides en tallo y hoja. Se utilizó la técnica de Wellburn
(1994).
f.
Albúminas en rizomas. Se utilizó la técnica
de Bradford (1976).
g. Densidad de granos de almidón por mL de agua destilada en rizomas. Se utilizó
una solución acuosa realizada
a partir de 1 cm3 de parénquima desmenuzado en 10 mL de agua destilada (D’Ambrogio, 1986; Hernández
& Arambarri, 2019).
Los datos obtenidos se analizaron mediante el software Statgraphics
Centurion XVI.
RESULTADOS
Las plantas con mayor crecimiento, que presentaron mejor
respuesta en los parámetros
fisiológicos analizados y que cumplimentaron su ciclo de vida con formación de frutos maduros, fueron aquellas cultivadas
en los tratamientos hidroponía en solución
y vermiculita (Figs. 2, 3, Tabla
1)
a. Altura final alcanzada
Las plantas que crecieron en la solución
de Hoagland (hidroponía) presentaron el mayor valor de altura, con diferencias significativas frente a las plantas
que crecieron en arena,
vermiculita y perlita. Con las plantas que crecieron en tierra no mostraron diferencias significativas, que fue el siguiente tratamiento en mostrar mejor respuesta
en este parámetro (Fig. 3, Tabla
1).
b.
Área foliar
El área foliar de las plantas
de C. indica presentó diferencias significativas entre los tratamientos realizados. Las plantas
que cre- cieron en hidroponía presentaron mayor área foliar,
mostrando diferencias significativas con los tratamientos perlita,
arena y tierra. El sustrato vermiculita presentó un valor eleva-
do de área foliar, sin diferencias significativas con las plantas
que crecieron en solución nu- tritiva (Tabla 1).

Figura 1. Etapas del ensayo de cultivo. A. fragmentos de rizoma para cultivo. B. Etapa
inicial del ensayo (22-VIII). C. Crecimiento de
las plantas (08-X). D. Crecimiento de
las plantas (02-XI). E. Crecimiento de las plantas
(12-XI). F. Crecimiento de las plantas (21-XI).
G. Floración (01-XII). H. Comienzo de la fructificación (01-XII). I. Obtención de frutos y semillas
a los (20-XII). Escala:
5 cm.
c. Peso fresco
El PFR fue mayor
al PFT y PFH, luego sigue el PFT con diferencias significativas según
el tratamiento (Fig. 4).
El PFH fue mayor en las plantas que cre- cieron en hidroponía, presentando diferencias significativas con el resto de los tratamientos; igual respuesta se observó en
el PFT (Fig. 4).
En el caso de los órganos subterráneos el comportamiento fue diferente; el mayor
valor de PFR se observó
en el tratamiento con vermiculita como sustrato,
seguido de perlita e hidroponía; el valor más bajo de PFR se registró en arena con diferencias significativas con el tratamiento de
vermiculita (Fig. 4).
d. Peso seco
La variable PS presentó
un comportamiento similar al
observado para el PF (Figs. 4, 5).
El PSH
no presentó diferencias significati- vas entre los tratamientos (Fig. 5). Sin embar-
go, el PST presentó mejor
respuesta en plantas obtenidas hidroponía con diferencias signifi- cativas respecto
al resto de los tratamientos (Fig. 5). Por otro lado, el PSR tuvo su valor más alto en el tratamiento con vermiculita, se- guido del tratamiento de perlita, hidroponía y tierra; solo se observaron diferencias signifi- cativas con el tratamiento de arena, que fue el más bajo (Fig. 5).
e. Clorofila a, b, total y carotenoides
El contenido de clorofila
a fue significativamente mayor en las plantas que crecieron en hidroponía, perlita
y arena, respecto a las que crecieron en tierra y vermiculita (Fig. 6). Una respuesta similar se observó
en el contenido de clorofila
total y carotenos, mientras
que el contenido de clorofila b fue significativamente mayor en hidroponía y
perlita, respecto a tierra (Fig. 6).
f. Proteínas
El contenido de proteínas solubles en agua extraídas
de los órganos subterráneos fue mayor en las plantas
que crecieron en vermiculita y el valor más bajo observado
fue en hidroponía, con diferencias estadísticamente significativas; el resto de los
tratamientos mostraron valores intermedios y sin diferencias estadísticas (Tabla
1).
g. Densidad de granos de almidón
La densidad de granos de
almidón de los rizomas de las plantas
de C. indica presentó diferencias significativas entre los tratamientos ensayados. La mayor densidad
de granos de almidón se observó
en las plantas que crecieron
en vermiculita e hidroponía; con valores significativamente menores siguió
el tratamiento tierra, perlita
y arena (Tabla 1).
|
Tratamientos
|
Altura (cm)
|
Área Foliar (cm2)
|
Proteínas (mg.g-1 PF)
|
Densidad granos de almidón (nº de granos de
almidón. mm-2)
|
|
Perlita
|
72,5 a
|
1490,34 a
|
7,61 ab
|
472222 a
|
|
Vermiculita
|
92,42 ab
|
3667,63 ab
|
8,81 b
|
776083 b
|
|
Arena
|
93,0 ab
|
1517,78 a
|
7,08 ab
|
430556 a
|
|
Tierra
|
109,1 ab
|
1691,18 a
|
7,13 ab
|
568700 a
|
|
Hidroponía en solución
|
132,0 b
|
6494,69 b
|
6,37 a
|
726042 b
|
Tabla 1. Altura, área foliar, contenido de proteínas y densidad
de granos de almidón de plantas de Canna indica, que crecieron
en diferentes sustratos.
Letras distintas indican diferencias significativas entre tratamientos (p<0,05).

Figura 2. Sustrato vermiculita. A. Fragmentos de rizoma
para cultivo. B. Macetas con el sustrato (22 agosto).
C. Parte aérea de las plantas
(20 setiembre). D. Parte aérea de las plantas (4 octubre).
E. Parte aérea de las plantas (2 noviembre). F. Parte
aérea de las plantas con floración (21 noviembre). G. Producción de frutos
(19-XII). H. Uno de los rizomas
obtnídos al finalizar
el ensayo (20-XII). Escalas: A, B, C, D, E y H = 10 cm; F = 5 cm; G = 1cm.

Figura 3. Hidroponía. A. fragmentos de rizoma
para cultivo. B. Etapa macetas con el sustrato (20 agosto).
C. Parte aérea de las plantas
(20 setiembre). D. Parte aérea de las plantas (4 octubre).
E. Parte aérea de las plantas (2 noviembre). F. Parte
aérea de las plantas con floración (19 diciembre). G. Producción de frutos (19 diciembre). H. Uno
de los rizomas obtenídos al finalizar el ensayo (20 diciembre). Escalas:
A, B, C, D, E y H = 10 cm;
F = 5 cm; G = 1 cm.
DISCUSIÓN
Popenoe et. al (1990) mencionan que C. indica, es una de las especies más resistentes para el cultivo
alimenticio, pues crece bien
hasta los 2.900 m s.m., en una amplia
variedad de climas, bajo temperaturas que oscilan entre los 9ºC y 32 ºC, prosperando en distintos tipos de suelo
que no son aptos para el cultivo
de tubérculos y rizomas, tolerando suelos ácidos a levemente alcalinos (pH 4,5 a 8) con un alto contenido de hierro y óxido de aluminio.
En un cultivo
tradicional, los rizomas
de esta especie pueden comenzar
a cosecharse a los 6 meses de su siembra (momento
en el cual, el rizoma es más suculento) o entre los 8-10 meses (cuando presenta
tallos florecidos y rizomas de mayor calidad,
hinchados al máximo
y ricos en fibra).
En condiciones
favorables tradicionales, a cuatro meses de la siembra de rizomas, se obtienen 23 tn de rizomas/ha-1, y a
los doce meses se obtienen 85 t/ha-1, siendo
el rendimiento del almidón de 2 a 10 tn/ha-1 (Popenoe et. al, 1990).
En este trabajo, mediante el cultivo no convencional, se obtuvieron plantas que realizaron su ciclo
de vida en cuatro meses luego de realizada la siembra
de segmentos de rizomas,
obteniéndose rizomas óptimos
para el consumo.
En general, el cultivo
comercial tradicional de esta especie no requiere mayores cuidados ni la aplicación de insumos, por ser una 10, 10-20-20 y 15-15-15), donde el agregado de estos macronutrientes es fundamental para un
óptimo crecimiento (Rodríguez
Borray et al., 2003). Sin embargo,
no existe mucha información del cultivo de esta planta en
condiciones de hidroponía, ya sea en solución
o en sustrato.
Tal como menciona Beltrano
& Giménez (2015),
el método no tradicional de cultivos
vegetales por hidroponía, reduce la erosión
y desgaste de los suelos por la aplicación de fertilizantes y productos fitosanitarios de síntesis química; según los autores,
al ser este tipo de cultivo, un ambiente inorgánico controlado, se reduce la aparición
de enfermedades radiculares.
De acuerdo con los resultados obtenidos
en este trabajo,
en los parámetros de crecimiento, se observó una respuesta favorable
cuando se realizó el cultivo
de la achira en hidroponía con solución
de Hoagland. La altura
de las plantas, el área foliar y los pesos frescos y secos corroboran esta respuesta. Canna
sp. puede crecer tanto en ambientes
terrestres como acuáticos (humedales), pero poco se sabe sobre sus requerimientos nutricionales (Konnerup & Brix, 2010). En este ensayo se utilizó una solución
nutritiva convencional con aporte de nitrógeno el cual es esencial
para el crecimiento vegetativo
de la planta, la formación
de nuevas hojas
y el aumento de la biomasa aérea. Según el trabajo
realizado por Konnerup
& Brix (2010) C. indica
creció bien en solución hidropónica independientemente de la fuente de N utilizada, NH + o NO -. Ni43 planta bastante rústica,
excepto riegos durante períodos de sequía
prolongados (Tapia
& Fries, 2007). Según Morales López (2019) se puede plantar
en todo tipo de terreno
dando prioridad a suelos ricos,
orgánicos y si el suelo posee
pocos nutrientes amerita la adición de fertilizantes o compost. En algunos ambientes, cuando se cultiva esta especie para la obtención de almidón,
se requiere la aplicación
de fertilizantes químicos
para obtener un crecimiento y rendimiento adecuado. Estos fertilizantes
son de tipo N-P-K, (nitrógeno – fósforo – potasio)
siendo frecuente el uso de las
fórmulas aplicadas al cultivo de papa (10-30-la partición de biomasa ni los parámetros morfológicos fueron afectados
por la fuente de N suministrada.
Como se observó
en los resultados obtenidos y en coincidencia con la bibliografía, una correcta formulación de la solución nutritiva
permite obtener plantas de mejor tamaño y calidad,
así como también
mayor tamaño de fruto. En muchos casos, el tiempo de
desarrollo de la planta se acorta, como se observó
en este trabajo coincidiendo con el
cultivo de otras especies como la lechuga (Beltrano & Giménez, 2015).
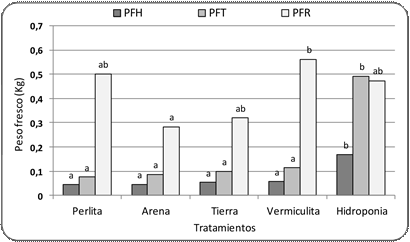
Figura 4. Peso fresco de hojas, tallos y raíces de plantas de Canna indica en diferentes
sustratos. Letras
distintas indican
diferencias significativas entre tratamientos (p<0,05).
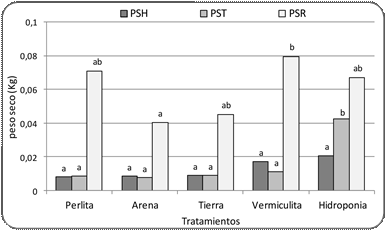
Figura 5. Peso seco de hojas, tallos y raíces de plantas de
Canna indica en diferentes sustratos.
Letras
distintas indican
diferencias significativas entre tratamientos (p<0,05).
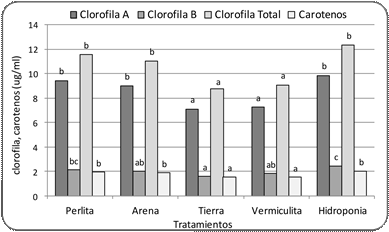
Figura 6. Contenido de clorofila A, B, total y carotenos
de plantas de Canna indica conque crecieron
en
diferentes sustratos.
Letras distintas indican diferencias significativas entre tratamientos
(p<0,05).
En este ensayo, además del tratamiento con solución de Hoagland,
el tratamiento en el cual las plantas
crecieron en vermiculita mostró una respuesta favorable en los parámetros de
crecimiento, diferenciándose MELISSA (Micro-Ecological Life Support System
Alternative), el cual constituye un sistema
regenerativo cerrado (CRLSS:
Closed Regerative Life Support
Systems) que absorbe el CO , emite O2 , purifica el significativamente del resto de los tratamientos. Una respuesta
similar se observó en el contenido de proteínas solubles en agua y en la densidad de granos de almidón.
En cuanto al contenido de pigmentos, tanto clorofila como carotenoides, observamos una respuesta favorable
cuando los rizomas crecieron en solución
de Hoagland, perlita y arena. Estos
dos últimos sustratos son muy utilizados
en este tipo de cultivo porque agua por transpiración y recicla desechos por medio de nutrición
mineral, e incluye
un área de producción de plantas superiores con énfasis en plantas alimenticias (Godia, 2004; Hendrickx
et al., 2006).
De esta manera, el cultivo de C. indica, también podría
ocupar un rol esencial
dentro de los sistemas
de soporte vital bio-regenerativo necesarios para la exploración espacial, aportando al hábitat de los astronautas, alimento, disminución de CO , producción de O , reciclaje de presentan varias características
favorables como porosidad apropiada, estabilidad física, disponibilidad en el mercado y bajo costo.
Otra propiedad que diferencia estos sustratos
de otros es la baja capacidad de intercambio
catiónico (CIC) que no supera los 10 meq.L-1 (Beltrano & Giménez, 2015). En los actuales sistemas de cultivos sin suelo, en los que con la nueva
tecnología existente se puede formular de forma cómoda las soluciones nutritivas, suelen usarse
sustratos con una baja CIC, o sea, que sean químicamente inertes o de muy
baja actividad (Moreno, 2007).
Cuando la CIC es baja o nula el material
actúa exclusivamente como medio de soporte para el cultivo,
sin ejercer influencia sobre el intercambio de minerales de los que se nutre la planta. Estas características mencionadas de los sustratos, tienen relación directa
con la disponibilidad de los nutrientes y especialmente con aquellos que presentan alta movilidad como el N y el Mg, ambos componentes de la molécula
de clorofila. Esto puede explicar
las diferencias encontradas respecto al contenido
de pig- mentos fotosintéticos en estos tratamientos al igual que en el tratamiento donde los rizomas crecieron directamente en solución nutritiva.
Por otra parte, la potencialidad y habilidad de las plantas para cumplir su ciclo de vida fuera de nuestro planeta (Ivanova et al.,1993,
Musgrave, 2007), las convierte
en un recurso de gran importancia en la exploración espacial. En este sentido, la Agencia
Espacial Europea (ESA)
ha trabajado en el Proyecto residuos, gestión del agua e incluso,
tener un impacto positivo
en la salud psicológica de la tripulación (Zabel et. al., 2016).
CONCLUSIÓN
El cultivo de C. indica
realizado en los sustratos
hidroponía en solución y vermiculita,
en condiciones controladas de invernáculo, permite
la producción de rizomas de mayor tamaño y calidad
respecto a los restantes
sustratos ensayados,
en menos de cuatro meses,
donde las plantas
lograron completar satisfactoriamente su ciclo de vida. Esta técnica de cultivo no convencional de C. indica permite la cosecha manual de fragmentos
de rizomas, sin destruir al organismo
vegetal que los produce, permitiendo la propagación de la especie y que ésta continúe
produciendo el órgano alimenticio. El cultivo no convencional de C.
indica podría aportar alimento suplementario a poblaciones
humanas situadas en ambientes extremos de nuestro
planeta e incluso
fuera de éste, como parte de los sistemas de soporte
vital ensayados en la NASA y en la ESA.
AGRADECIMIENTOS
Agradecemos a la Dra. Ana María Arambarri, especialista en Morfología y Anatomía Vegetal, Directora del Laboratorio de Morfología Comparada de Espermatófitas (LAMCE) de la Facultad
de Ciencias Agrarias y Forestales de la Plata (FCAyF), Universidad Nacional de La Plata (UNLP), por la lectura crítica
del manuscrito. Asimismo, agradecemos el apoyo técnico
e intelectual, brindado por el
Instituto de Fisiología Vegetal (INFIVE-FCAyF-UNLP) y por el Instituto de Astrobiología de Colombia (IAC).
Por último, agradecemos a los revisores por sus valiosos aportes.
BIBLIOGRAFÍA
Antillón, L. A. (2004).
Hidroponía, Cultivo
sin tierra. (1º Ed). Editorial Tecnológica de Costa Rica.
Barrera , V. H., Tapia, C. G., &
Monteros, A. R. (Eds.).
2004. Raíces y Tubérculos
Andinos: Alternativas para la conservación y uso sostenible en el Ecuador. Serie: Conservación y uso de la biodiversidad de raíces y tubérculos
andinos. Una década de investigación
para el desarrollo (1993-2003). No.4. Instituto
Nacional Autónomo de Investigaciones Agropecuarias, Centro
Internacional de la Papa, Agencia
Suiza para el Desarrollo y la
Cooperación. Quito, Ecuador - Lima, Perú.
Beltrano, J., & Gimenez,
D. O. (2015). Cultivo
en hidroponía. Editorial de la Universidad Nacional
de La Plata (EDULP). https://doi. org/10.35537/10915/46752
Bradford, M. M. (1976).
A rapid and sensitive method for the quantification of microgram
quantities of protein utilizing the principle of protein-dye binding. Analytical Biochemistry, 248-254. https://doi.org/10.1006/ abio.1976.9999
Bueno Prieto, J. E., & Martínez Frías,
J. (2021). Desierto de la Tatacoa: Marte en Colombia.
https://doi.org/10.21028/jbp.2021.12.09
Cabrera, A. L. (1976). Regiones Fitogeográficas Argentinas. Enciclopedia Argentina
de Agricultura y Jardinería. Fasciculo I, Tomo II, (2º Ed,), ACME S.A.C.I,
Buneos Aires, Argentina.
Cañar Inga, E. A., & Paguay Verdugo,
E. M. (2017). Estandarización de la técnica
de microdilución de actividad antifúngica de extractos hidrofílicos y liofílicos de plantas medicinales frente a Candida albicans. Facultad de Ciencias
químicas Carrea de Bioquímica y Farmacia. Ecuador
[tesis doctoral, Universidad de Cuenca].
Chavarría-Torrez, A., &
Castillo-Castro, S. D. (2018). El forraje verde hidropónico (FVH), de
maíz como alternativa alimenticia y nutricional para todos los animales de la granja.
Revista Iberoamericana de
Bioeconomía y Cambio Climático, 4 (8), 1032-1039. https://doi. org/10.5377/ribcc.v4i8.6716
Cowles, J. R., LeMay, R., Jahns,
G., Scheld, W. H.,
& Peterson, C. (1989). Lignification in young
plant seedlings grown on earth and aboard the space shuttle. En: Lewis N. G. & Paice M. G. (Eds.). Plant
Cell Wall Polymers. Biogenesis and Biodegradation. ACS Symposium
Series. American
Chemical Society; Washington, DC, USA, 399, 203-213.
https://doi.org/10.1021/ bk-1989-0399.ch015
D’Ambrogio, A. (1986). Manual
de técnicas en histología vegetal. Hemisferio Sur, Buenos Aires, Argentina.
Espinosa, P., Vaca, R., Abad, J., & Crissman, C. (1997). Raíces
y tubérculos andinos. Cultivos
marginados en el Ecuador:
situación actual y limitaciones para la producción. Ediciones Abya-Yala. Quito, Ecuador.
Figueroa Cardozo, Y., & Galeano,
G. (2004). Guía ilustrada de la flora del Desierto
de la Tatacoa, Huila, Colombia.
Acta Biológica Colombiana, 29(2),
263-281.
Florez Molina, M.T., Parra Sánchez, L. N., Jaramillo Jaramillo, D.F., & Jaramillo
Mejía,
J.M. (2018). Evidencias macromorfológicas y micromorfológicas
de paleosuelos en el desierto
de La Tatacoa y su variación sincrónica. Revista de la Academia
Colombiana de Ciencias Exactas,
Físicas y Naturales, 42(165), 422-438. https://doi. org/10.18257/raccefyn.702
Godia, F., Albiol,
J., Perez, J., Creus, N., Cabello, F., Montras,
A., Masot, A., & Lasseur, C. (2004). The MELISSA pilot plant facility as an integration test-bed
for advanced life support
systems. Advances in Space Research, 34,1483–1493. https://doi.org/10.1016/j. asr.2003.08.038
Gómez, F. (2016). Vida en ambientes extremos. Investiga I+D+i.
http://www. programainvestiga.org/pdf/guias2016-17/ Guia%20introductoria%20al%20tema%20 vida%20en%20ambientes%20extremos.pdf
Grau, R. H., Babot, M. J., Izquierdo, A. E., & Grau,
A. (2018). La Puna Argentina: naturaleza y cultura. Serie Conservación de la Naturaleza
Nº 24. https://doi.org/10.1659/mrd.mm233
Hendrickx, L., de Wever, H., Hermans, V., Mastroleo, F., Morin, N., Wilmotte, A., Janssen, P., &
Konnerup, D., &
Brix, H. (2010).
Nitrogen nutrition
of Canna indica: effects of ammonium versus
nitrate on growth, biomass allocation, photosynthesis, nitrate reductase activity and N uptake rates. Aquatic Botany, 92 (2), 142-148. https://doi. org/10.1016/j.aquabot.2009.11.004
Hernández, M.P., Civitella, S. M. &, Rosato,V. G.
(2010). Uso medicinal popular
de plantas y líquenes de la Isla Paulino, Provincia de Buenos Aires,
Argentina. Boletín Latinoamericano del Caribe Plantas
Medicinales Aromática, 9(4), 258-269.
Hernández, M., P.,& Arambarri , A.,M. (2019).
Variación estacional
de la densidad de granos de almidón
en rizomas de Canna glauca y
C. indica (Cannaceae). Lilloa, 56(2), 37-46. https://doi.org/10.30550/j.lil/2019.56.2/3
Hernández, M. P., Calonge,
F. S., Morandi, L.A., Katinas,
L., & Arambarri,
A. M. (2019). Uso tradicional de las plantas
puneñas en la localidad Tolar Grande, Provincia de Salta (Argentina). XXXVII Jornadas
Argentinas de Botánica, Tucumán, Argentina.
Boletín de la Sociedad Argentina de Botánica, 54 (Supl.), 174-175.
Hernández, M.P., Carbone,
A.V., Katinas, L., Arambarri, A, M., Carrasquero, S., Morandi,
L. A., Calonge,
F., Araujo, M., &
Gutiérrez,
M. T.
(2020). Plantas vasculares puneñas y altoandinas de la provincia de Salta
(Argentina) para la terraformación del planeta marte.
V Congreso Internacional de Astrobiología. Instituto de Astrobiología de Colombia (IAC). Universidad
de Atlántico, Bogotá. Colombia.
Hurrell, J. A., Bazzano,
D. H. &, Delucchi, G. (2005). Monocotiledóneas Herbáceas Nativas y
Exóticas. En Hurrell, J. A. (ed.).
Biota Rioplatense X, 1-320. Buenos Aires, Lola.
Jost, A. I., Hoson, T. &, Iversen,
T. H. (2015). The Utilization of Plant Facilities on the International Space Station-The
Composition, Growth, and Development of Plant Cell Walls under Microgravity Conditions. Plants (Basel, Switzerland), 4(1), 44-62. https://doi. org/10.3390/plants4010044
Ivanova, T. N., Bercovich, Y. A., Mashinskiy,
A. L., & Meleshko,
G. I. (1993). The 1st space vegetables have been grown in the svet greenhouse using controlled environmental- conditions. Acta
Astronautica, 29: 639- 644. https://doi.org/10.1016/0094- 5765(93)90082-8
MacElroy, R. D. (1974).
Some comments on the evolution of extremophiles. Biosystems, 6, 74-75.
Martínez Crovetto,
R. 1981. Plantas utilizadas
en medicina en el noroeste
de Corrientes (República Argentina)”. Fundación Miguel Lillo. Miscelánea, 69, 1-139.
Marzocca, A. (1993). Vademécum de Malezas Medicinales de la Argentina indígenas y exóticas. Orientación Gráfica Editorial S.R.L.,
Buenos Aires, Argentina.
Medina, F. J. (2020). Space
explorers need to be space farmer. What we know and what we need to know about plant growth
in space. University of Valencia, Metode Science Studies Journal, 11, 55-62. https://doi.org/10.7203/ metode.11.14606
Monje, C. (2001).
La Tatacoa. Ecosistema estratégico de Colombia. Editorial
Universidad Surcolombiana.
Montaldi, E. R. (1995). Principios de Fisiología Vegetal. (1º Ed.). Ediciones Sur, La Plata, Argentina.
Morales López, D. A. (2019).
Proyecto para la elaboración y comercialización de té de achira en la ciudad de Quito-Ecuador [tesis doctoral, Universidad Central del Ecuador].
Moreno, N. R. (2007).
Manual de producción de tomate rojo bajo condiciones de invernadero para el calle de Mexicali, Baja California. Fundación produce,
gobierno de Baja California, México.
Musgrave, M. E. (2007).
Growing plants
in space. CAB Reviews: Perspectives. In Agriculture, Vetetinary Science, Nutrition ando Natural
Resourses, 2 No. 065. https:// doi.org/10.1079/PAVSNNR20072065
Paradiso, R., de Micco, V., Buonomo, R., Aronne,
G., Barbieri, G., & de Pascale, S. (2014).
Soilless cultivation of soybean for bioregenerative life-support systems:
A literature review
and the experience of the MELISSA project - Food characterisation
phase I. Plant Biology,16, 69-78. https://doi. org/10.1111/plb.12056
Pocchetino, M.L. (2015).
Botánica económica. Las plantas interpretadas según tiempo, espacio y cultura. Sociedad Argentina de Botánica.
Popenoe, H., King, S. R., León, J., & Sumar
Kalinowsky, L. (1990). Lost Crops of the Incas.
National Academy
Press. Washington
D. C., 3-15.
Rendón, J. B., & Ramírez Jiménez, E. A. (2012).
Espacios globales y resistencias locales, en el bosque seco tropical La Tatacoa. Ciudad
Paz-ando, 5(1), 137-150.
https://doi. org/10.14483/2422278X.7295
Rapoport, E. H., Marzocca,
A., & Drausal,
B.S. (2009). Malezas comestibles del Cono Sur y
otras partes del planeta. Instituto Nacional de Tecnología
Agropecuaria, Universidad Nacional del Comahue.
Rodríguez Borray, G. A., García Bernal,
H. R., Camacho Tamayo,
J. H., & Arias, F. L. (2003). El almidón de achira o sagú (Canna edulis
Ker). Manual Técnico para su elaboración.
Corporación Colombiana de lnventigación
Agropecuaria. Subdirección de lnvestigación e Innovación Tecnológica. Programa
Nocional de Procesos Agroindustriales. Colombia.
Romero Vásquez,
S. M., & Valdez Valles,
J. A. (2016). Capacidad antioxidante in vitro de los flavonoides totales
del estracto fluído
de las hojas de Canna
indica L. (achira) frente al radical libre 2,2-difetil-1-picrilhidracio [tesis doctoral, Universidad Nacional de Trujillo].
Ruyters, G., & Braun,
M. (2014). Plant biology in space: recent
accomplishments and recommendations
for future research. Plant Biology, 16: 4–11. https://doi. org/10.1111/plb.12127
Tapia, M. E., & Fries,
A. M. (2007). Guía de campo de los cultivos andinos. FAO y ANPE.
Lima.
Wellburn, A. R. (1994).
The spectral determination of chlorophylls A and B, as well as Total caroteinds, using various solvents with Spectrophotometers of different resolution. Journal of Plant Physiology,
144, 307-313. https://doi.org/10.1016/S0176-1617(11)81192-2
Yaruro Cáceres, N.
C., Suarez Mahecha, H., de Francisco, A., Vásquez Mejía, S. M., &
Daz Moreno, C. (2021). Physicochemical, thermal, microstructural and paste properties comparison of four achira (Canna edulis sp.) starch ecotypes. International Journal of Gastronomy and Food Science, 25. https://doi. org/10.1016/j.ijgfs.2021.100380
Zabel, P., Bamsey, M., Schubert, D., & Tajmar, M. (2016). Review and analysis of over 40 years
of space plant growth systems. Life Sciences in Space Research,
10, 1-16. https://doi. org/10.1016/j.lssr.2016.06.004
, Marcela F. Ruscitti1, 2, 5
, Felipe S. Calonge2
, Alejanda V. Carbone1, 2
& Jorge E. Bueno Prieto6