
Situación Actual
y Avances
en la Detección de la Infección de Strongyloides stercoralis en la Provincia de Salta (Argentina)
Current Situation and Advance in the Detection of the Strongyloides stercorlis Infection in the Province of Salta (Argentinta)
Rubén O. Cimino

Instituto de Investigaciones de Enfermedades Tropicales (IIET), Facultad Regional Orán. Cátedra de Química Biológica-Facultad de Ciencias Naturales, Universidad Nacional de Salta, Av. Bolivia 5150 (A4408FVY), Salta, Argentina. rubencimino@gmail.com https://orcid.org/0000-0002-4253-9077
Resumen
Las geohelmintiasis (STH: soil transmitted helminths) o parasitosis intestinales son un grupo de parásitos transmitidos por el suelo, agua y ambientes
contaminados por materia fecal. El Strongyloides stercoralis, es un parásito
de amplia distribución en el mundo y afecta entre 380 a 600 millones
de personas en el mundo. La epidemiologia de S. stercoralis, todavía tiene vacíos de conocimiento, entre ellos el diagnóstico rápido, seguro y preciso.
Desde la Universidad Nacional de Salta se vienen desarrollando hace más de 10 años actividades de investigación con el objetivo de mejorar la precisión en el diagnóstico. Nuestra experiencia abarca mejoras en el diagnóstico parasitológico, combinando hasta 4 técnicas
como sedimentación-concentración; Baermann, Harada-Mori y placa de agar. Paralelamente, las técnicas inmunoenzimáticas (por ejemplo, ELISA o inmunoblot) y moleculares (qPCR, LAMP y Multiplex
PCR) están mejorando la calidad del diagnóstico. Los avances logrados en la actualidad son importantes, pero aún falta trabajar en aspectos como: 1) desarrollo de plataformas moleculares para detectar varias especies de STH; 2) desarrollo de pruebas para la detección de resistencia a drogas in situ; 3) desarrollo
de biomarcadores específi y sensibles
para decidir cuándo poner fin a un tratamiento y 4) estandarizar los procedimientos de diagnóstico y confeccionar directrices. Las STH siguen siendo un problema de salud pública, a la fecha hay evidencias
suficiente que sugieren que se puede diseñar alguna plataforma inmunológica y/o molecular para el diagnóstico de la infección de S. stercoralis, para ser aplicado por el sistema de salud pública en zonas de alta endemicidad como es el norte de Salta.
Palabras clave: Diagnóstico;
Geohelmintiasis; Salta (Argentina); Serología
Abstract
Geohelminthiasis (STH: soil-transmitted helminths) or intestinal parasitosis are a group of
parasites transmitted by soil, water, and environments contaminated by fecal matter. Strongyloides stercoralis is a parasite with a wide distribution in the world and affects between 380 to 600 million people in the world.
The
epidemiology of S. stercoralis still has gaps in knowledge, including rapid, safe, and accurate diagnosis. From the National University of Salta, research
activities have been carried out
for more than 10
years with the aim of improving
diagnostic accuracy. Our experience covers improvements in parasitological diagnosis, combining up to four techniques such as sedimentation-concentration, Baermann,
Harada-Mori, and an agar plate. In parallel, immunological techniques (for example,
ELISA or immunoblot) and molecular (qPCR, LAMP, and Multiplex PCR) are improving the quality of diagnosis. The advances achieved
at present are important, but there is still work to be done in aspects such as; 1) the development of molecular platforms
to detect several STH species; 2) the development of on-site resistance screening tests; 3) the development of specific and sensitive
biomarkers to decide when to stop treatment and 4) standardize diagnostic procedures and develop guidelines.
STH continues to be
a public health problem, to date
there is sufficient
evidence to suggest
that an efficient immunological and/or molecular platform can be designed for the diagnosis of S. stercoralis infection, to be applied
by the public health system. in areas of high endemicity such as the north of Salta.
Keywords: Diagnosis; Geohelminthiasis; Salta (Argentina); Serology

Cimino, R. O. (2023).
Situación actual y avances
en
la detección de la infección de
Strongyloides stercoralis en la provincia de Salta. Revista Ciencias Naturales, 1(2), 92–98.
Recibido: 2/5/2023 Aceptado: 31/7/2023 Publicado: 15/8/2023 Editor
Asociado: Ricardo
Alonso
Introducción
La Organización Mundial de la Salud, propuso agrupar a 20 enfermedades como Enfermedades Tropicales Desatendidas (NTDs: Neglected Tropicales Diseases) estas enfermedades se caracterizan por ser prevalentes principalmente en áreas tropicales, que afectan a más de mil millones de personas
pertenecientes de comunidades empobrecidas. Entre estas enfermedades encontramos a la Enfermedad de Chagas, dengue,
leishmaniasis y geohelmintiasis, entre otras (Organización Mundial de la Salud, 2021).
La geohelmintiasis (STH: soil transmitted helmintos) afecta a uno de cuatro individuos
en el mundo, e involucra
a cinco especies de parásitos: Ascaris
lumbricoides, Trichu- ris trichiura, uncinarias (Ancylostoma duodenale y Necator americanus), y más recientemente Strongyloides stercoralis (Fig.1). Las estrategias para el control
y erradicación están orientadas principalmente a la intervención mediante administración de tratamiento (antiparasitarios) como así también a las mejoras
y acceso a agua potable, saneamiento (cloacas) oportunidades en el desarrollo socioeconómico (Chan et al.,
2023; Krolewiecki et al., 2013).
La particularidad que tiene la biología de S.
stercoralis, que lo diferencia de los demás helmintos, es que tiene
un ciclo de vida que involucra el suelo (vida libre)
y otro de autoinfección dentro del humano,
esto permite perpetuar la infección (Fig. 2). Otra diferencia es que es el único helminto que se libera como larva en la materia
fecal, los demás se liberan como huevos. Esta liberación es intermitente
y por la tanto la detección por métodos
parasitológicos es un problema (Cimino
& Krolewiecki, 2014).
Las similitudes y características distintivas de S. stercoralis
con los demás helmintos se resumen en la Tabla 1. De acuerdo con esto se puede entender
las dificultades que tiene
el diagnóstico y pensar en el diseño de
nuevas estrategias que se complemente con el tradicional método parasitológico.
Los primeros estudios
moleculares acerca de la variabilidad genética
de S. stercoralis analizando el gen cox1 (citocromo c oxidasa
subunidad 1, gen mitocondrial) como marcador molecular
en Latino América, permitió
identificar la presencia
de 10 ha- plotipos organizados en dos clústeres. Si bien todavía no se encontró asociación entre los haplotipos y presentación clínica o estatus inmunológico, se debe continuar estudiando más en profundidad, usando otros marcadores moleculares (Repetto
et al., 2022).
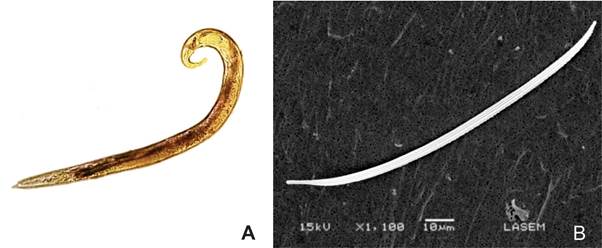
Figura 1. Strongyloides stercoralis. A. aspecto microscópico con microscopio de luz. B. vista con microscopio electrónico de barrido.
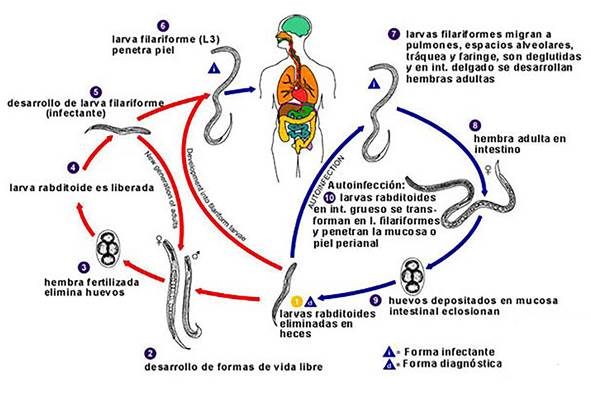
Figura 2. Ciclo de vida del Strongyloides stercoralis. Tomado de Strongyloides_LifeCycle_lg.jpg (cdc.gov).
|
Características
|
Ascaris
lumbricoides
|
Trichuris
trichiura
|
Ancylostoma
duodenale
|
Necator
americanus
|
Strongyloides
stercoralis
|
|
Multiplicación dentro del hospedador/ autoinfección
|
-
|
-
|
-
|
-
|
+++
|
|
Morbilidad aguda/crónico
|
+/+++
|
+/+++
|
++/++++
|
+/+++
|
++/++++
|
|
Potencial fatalidad
|
+
|
-
|
++
|
+
|
++++
|
|
Diagnóstico
|
huevo
|
huevo
|
huevo
|
huevo
|
larva
|
|
Medición de la intervención
|
cura o descenso
de la carga de parásitos
|
cura o descen-
so de la carga de parásitos
|
cura o descenso de la carga
de parásitos
|
cura o descenso de la carga
de parásitos
|
cura
|
|
Medición de la intervención
|
tasa de cura y tasa
de reduc- ción de huevos
|
tasa de cura y tasa
de reduc- ción de huevos
|
tasa de cura
y tasa de re- ducción de huevos
|
tasa de cura
y tasa de reducción de huevos
|
tasa de cura
|
Tabla 1. Principales características de los geohelmitos y Strongyloides stercoralis (Krolewiecki
et al., 2013).
Técnicas para la detección
de Strongyloides stercoralis
Técnicas Parasitológicas
Actualmente
los métodos
parasitológicos son las pruebas
de referencia para la detección
de larvas de S. stercoralis, se basan en la examinación
de la materia fecal, tejido en biopsias o lavado broncoalveolar al microscopio de forma directa. Los métodos
coproparasitológicos son: 1) sedimentación- concentrado, 2) Baermann, 3) placa de agar
y 4)
Harada-Mori, estos métodos tienen las desventajas de poseer baja sensibilidad, son laboriosos y son operador dependiente (Gelaye et
al., 2021; Krolewiecki et
al., 2013). La combinación de estos métodos permite mejorar la sensibilidad, según algunos
reportes. La examinación de múltiples muestras es otra estrategia para aumentar la sensibilidad de estos métodos. El método de Baermann según los reportes puede detectar cuatro veces más casos que el método de
sedimentación-concentración. En los casos de infecciones crónicas donde la carga parasitaria
es baja la sensibilidad de estos métodos se ve disminuida (Knopp et al., 2014).
Métodos serológicos
Los métodos inmunoenzimáticos como ELISA (immunosorbent assay),
IFAT (inmu- nofluorescencia test), western blot, LIPS
(luciferase immunoprecipitacion system assay) y más recientemente tiras reactivas inmunocromatográficas (dpstick
test IgG4 SSRapid),
son usados como alternativas para el diagnóstico de la infección por S. stercoralis y
presentan ciertas ventajas
sobre los métodos parasitológicos (Tabla 2) (Bisoffi et
al., 2014; Krolewiecki et al., 2010). Varios estudios
han demostrado que las pruebas
serológicas tienen alta sensibilidad, dependiendo de tipo de prueba evaluada.
El rango de sensibilidad y especificidad de las diferentes pruebas diagnósticas varían entre el 43% al
100%. La evaluación de 5 métodos inmunológicos (entre ellos ELISA comerciales, IFAT in- house,
antígenos recombinantes NIE en ELISA y LIPS) realizado
por Bisoffi et al.,
2014, revelaron una sensibilidad entre un 75% al 94%, comparados con IFAT usado como
prueba de referencia. La sensibilidad puede reducirse en pacientes
inmunosuprimidos, en un estudio en
Tailandia se reportó una sensibilidad del 43% usando
IgG ELISA. Recientemente, un kit comercial
ELISA (Strongy Detect, Inbios) combinando los antígenos recombinantes NIE/SSIR para detectar anticuerpos de los tipos IgG e IgG4,
tuvieron una sensibilidad del 92% y 81%, respectivamente, mientras que la especificidad
fue del 91% y 94%, respectivamente (Chan et
al., 2023).
Métodos moleculares
Las técnicas moleculares son una herramienta que se complementa con las técnicas
parasitológicas y serológicas permitiendo aumentar la precisión del diagnóstico. Las variantes
de técnicas van desde PCR convencional, Nested PCR, multiplex
PCR, Illumina, qPCR y más recientemente LAMP. Estas técnicas permiten la identificación
molecular de especies, filogenia y estudios de diversidad genética de S. stercoralis (Fleitas et al.,
2021; Chan et al., 2023; Knopp et al.,
2014). Las ventajas
y limitaciones se describen en la Tabla 2.
Avances en el diagnóstico de Strongyloides stercoralis a nivel local
El norte de la provincia de Salta es zona de alta endemicidad de la geohelmintiasis, las características ambientales, la pobreza, la
falta de accesibilidad al agua potable y cloacas
para la eliminación de excretas permite que aumente el riesgo de la contaminación del suelo por materia fecal.
Al año 2000, se reportaron prevalencias de geohelmintos
que alcanzaban el 70%, y la infección
por S. stercoralis de
un 50% (Taranto et
al., 2003).
El Instituto de Investigaciones de Enfer-
medades Tropicales (IIET) de la Universidad de Nacional
de Salta y en colaboración con otros grupos de investigadores vienen desarrollando actividades de innovación tec- nológica como así también
de búsqueda de estrategias para mejorar el diagnóstico de la
infección por S. stercoralis.
|
Métodos
|
Ventajas
|
Limitaciones
|
|
Parasitológicos
|
□
Bajo costo comparado a las técnicas inmunológicas y moleculares.
□ Fácil implementación en el campo.
|
□
Requiere gran cantidad de muestras para mejorar
la sensibilidad debido
a la irregularidad en la liberación de larvas en la materia
fecal.
□
Se puede confundir con larvas de uncinarias debido
a la similitud de morfología.
□ Requiere larvas vivas.
|
|
Inmunológicas
|
□
Alta sensibilidad, con respecto a los parasitológicos y técnicas moleculares.
□ No dependiente a la liberación de larvas.
□
Alta especificidad, principalmente los
antígenos recombinantes.
□
Se puede realizar usando otro material biológico como saliva y/o materia fecal.
□
Baja complejidad de equipamiento y adiestramiento técnico.
□
Tiras inmunocromatográficas son prácticas
para
diagnóstico de laboratorio y/o campo.
|
□
Potencial reacción cruzada
con otros helmintos (principalmente los extractos crudos
de parásitos como antigenos).
□
Persistencia de anticuerpos impide determinar si es infección presente o pasada (principalmente en área
endémicas).
|
|
Moleculares
|
□
Mayor sensibilidad que los métodos parasitológicos.
□
Alta especificidad con respecto a los
métodos serológicos.
□ Capacidad de detectar larvas muertas.
□
Aumenta la precisión para identificación
molecular de especies.
□
Capacidad de detectar otros helmintos mediante ensayos múltiples.
□
Detección de parásitos en otros
ambientes, como suelo y/o
orina.
|
□
Potencial reacción cruzada
con otros helmintos.
□
Falta de standard para PCR y
protocolo de extracción de
ADN, causando variación en la
sensibilidad y especificidad.
□
Por la irregularidad en la liberación de larvas se necesita aumentar el volumen de muestra.
|
Tabla 2. Ventajas y limitaciones de cada técnica para la detección de Strongyloides stercoralis.
(Chan et al.,
2023).
En el laboratorio del IIET de la Facultad
Regional Orán de la U.N.Sa., de forma rutinaria se realizan
cinco métodos coproparasitológicos: a) sedimentación con- centración, b) McMaster,
c) Harada-Mori, d) Baermann, y e) Placa de Agar. La posibilidad de contar con
todos estos métodos permite aumentar la sensibilidad para detectar
principalmente las larvas de S. stercoralis y otros helmintos. En un estudio
realizado en el norte de Salta, se pudo determinar una sensibilidad del 43,6%
(IC95%: 25,7%-70,4%) combinando tres métodos parasitológicos
(sedimentación-concentración, Harada-Mori y Baermann) (Krolewiecki et al., 2018).
Paralelamente
se fue avanzando en la incorporación de una serología para el diagnóstico específico, los
diferentes estudios donde se evaluó el ELISA-NIE con panel de sueros
del norte de Salta, se determinó una sensibilidad entre un 75%-85%,
y espe- cificidad del 94%-100%. Este antígeno no cruza con otros helmintos como uncinarias y A. lumbricoides. Además,
por este método
se puede detectar los falsos negativos de la coproparasitológica.
Si
bien la sensibilidad del ELISA-NIE puede
ser baja para el diagnóstico clínico,
representa un avance
importante y particularmente como herramienta para estudios
epidemiológicos como son los estudios
de prevalencias e impacto de intervención quimioterapéutica y de saneamiento en agua e higiene. De acuerdo
con esto, se estimó
que la prevalencia serológica en la región del noroeste es aproximadamente el 20% (IC: 19,4-22,4%).
Mientras que, en un estudio llevado
a cabo en la localidad de Pichanal,
se pudo puedo detectar seroconversión (cura serológica) en la población
y se pudo concluir
que el impacto combinado entre la intervención quimioterapéutica con antiparasitarios acom- pañado con mejoras en las condiciones de saneamiento e higiene mejora el estatus de salud poblacional (Cimino
et al., 2015;
Echazú et al., 2017; Vargas et
al., 2017).
Con el avance del
desarrollo biotecnológico y principalmente en el diagnóstico de la bio- logía
molecular, se desarrollaron y evaluaron las técnicas de qPCR y multiplex PCR para aumentar la sensibilidad del diagnóstico e identificación de especies de parásitos. Con esta
última técnica se pudo determinar una sensibilidad del 97,4% para S. stercoralis y
90,3% para uncinarias, y una especificidad del 100% y 87,6%,
respectivamente. Loimportante de este multiplex PCR es que se pudo detectar 4 veces más casos de coinfecciones
comparado con la parasitología (15,3% vs
3,5%). Con especto a la identificación de especies, se observó
una asociación positiva
entre S. stercoralis con
N. americanus (odds ratio= 3,22) (Cimino
et al., 2015; Fleitas
et al., 2021).
De manera exploratoria,
se iniciaron los primeros ensayos en el diagnóstico
de S. stercoralis, utilizando como material
biológico la orina
de pacientes, principalmente pensado en el desarrollo de una técnica
no invasiva alternativa a la extracción
de sangre.
La sensibilidad de la PCR para detectar ADN de S. stercoralis en orina fue de un 75% (IC95%: 54%-92%) (Krolewiecki et al., 2018). Estos resultados nos alientan a seguir trabajando y poder extrapolar
esta modalidad para el diagnóstico de otras patologías regionales como Enfermedad de Chagas o leishmaniasis cutánea.
Los avances en el diagnóstico son
importantes, aun así, todavía
falta trabajar en cómo se puede
transferir estas herramientas al sistema público de
salud y puede ser utilizado
el diagnóstico clínico.
Sin dudas es otro eslabón que se necesita introducirse
para poder vincular los logros en el campo científico con el sistema de salud asistencial y la industria
en salud.
Referencias
Bisoffi, Z., Buonfrate, D., Sequi, M., Mejia, R., Cimino, R. O., Krolewiecki, A. J.,
Albonico, M., Gobbo, M., Bonafini, S., Angheben, A., Requena-Mendez, A., Muñoz, J., & Nutman, T. B. (2014). Diagnostic accuracy of five serologic tests for Strongyloides stercoralis infection. PLoS Neglected Tropical Disease, 8(1), e2640. https://doi.org/10.1371/journal.pntd.0002640
Cimino, R. O., Jeun, R., Juárez, M., Cajal,
P. S., Vargas, P., Echazú, A., Bryan,
P. E., Nasser,
J., Krolewiecki, A., &
Mejia, R. (2015). Identification of human intestinal
parasites affecting an asymptomatic peri-urban Argentinian population using multi-parallel quantitative real-time polymerase
chain reaction. Parasites
Vectors., 8, 380. https:// doi.org/10.1186/s13071-015-0994-z
Cimino, R. O., & Krolewiecki, A. (2014).
The Epidemiology of Human Strongyloidiasis. Current Tropical
Medicine Reports, 1, 216-222. https://doi.org/10.1007/s40475-014-0035-6
Echazú, A., Juárez, M., Vargas, P. A., Cajal, S. P., Cimino,
R. O., Heredia,
V., Caropresi, S., Paredes,
G., Arias, L. M., Abril, M., Gold, S., Lammie, P., & Krolewiecki, A. J. (2017). Albendazole and ivermectin for the control
of soil-transmitted helminths in an area with high prevalence of Strongyloides stercoralis and
hookworm in northwestern Argentina: A community-based pragmatic study. PLoS Neglected
Tropical Disease, 11(10), e0006003.https://doi.org/10.1371/journal.pntd.0006003
Fleitas, P. E., Vargas, P. A., Caro, N., Almazán,
M. C., Echazú, A., Juárez, M., Cajal, P., Krolewiecki, A. J., Nasser, J. R., & Cimino, R. O. (2021). Scope and limitations
of a multiplex conventional PCR for the diagnosis
of S. stercoralis and
hookworms. The Brazilian Journal of Infectious Diseases, 25(6), 4-9.
https://doi.org/10.1016/j.bjid.2021.101649
Gelaye, W., Williams, N. A., Kepha, S., Junior, A. M., Fleitas,
P. E., Marti-Soler, H., Damtie, D., Menkir, S., Krolewiecki, A. J., Van Lieshout, L., & Enbiale, W. (2021).
Performance evaluation of Baermann techniques: The quest for developing a microscopy reference standard for the diagnosis
of Strongyloides stercoralis. PLoS Neglected
Tropical Disease, 15(2), 1-13. https://doi.org/10.1371/journal.pntd.0009076
Chan, A. H. E., & Thaenkham, U. (2023).
From past to present:
opportunities and trends in
the molecular detection and diagnosis
of Strongyloides stercoralis. Parasites
Vectors, 16, 123. https://doi.org/10.1186/s13071-023-05763-8
Knopp, S., Salim, N., Schindler, T., Karagiannis Voules, D. A., Rothen, J., Lweno, O., Mohammed, A. S., Singo,
R., Benninghoff, M., Nsojo,
A. A., Genton, B., & Daubenberger,C. (2014).
Diagnostic Accuracy of Kato-Katz, FLOTAC, Baermann,
and PCR Methods
for the Detection of Light-Intensity Hookworm and Strongyloides stercoralis Infections in Tanzania.
The American Journal
of Tropical Medicine
and Hygiene, 90(3), 535-545. https://doi.org/10.4269/ajtmh.13-0268
Krolewiecki, A. J., Koukounari, A., Romano, M., Caro, N. N., Scott, A. L., Fleitas,
P., Cimino, R., &
Shiff, C. J. (2018). Transrenal DNA- based diagnosis of Strongyloides stercoralis (Grassi,
1879) infection: Bayesian
latent class modeling of test accuracy. PLoS Neglected Tropical Disease, 12(6),
e0006550 https://doi. org/10.1371/journal.pntd.0006550
Krolewiecki, A. J., Lammie, P.,
Jacobson, J., Gabrielli,
A.-F., Levecke, B., Socias, E., Arias, L. M., Sosa, N., Abraham,
D., Cimino, R., Echazú, A., Crudo, F., Vercruysse, J., &
Albonico, M. (2013). A public health response
against Strongyloides stercoralis: time to
look at soil-transmitted helminthiasis in full. PLoS
Neglected Tropical Disease,
7(5), e2165. https://doi.org/10.1371/journal.pntd.0002165
Krolewiecki, A. J., Ramanathan, R., Fink, V., McAuliffe, I., Cajal, S. P., Won, K., Juarez,
M., Di Paolo, A., Tapia, L., Acosta,
N., Lee, R., Lammie, P., Abraham, D., &
Nutman, T. B. (2010). Improved diagnosis
of Strongyloides stercoralis using recombinant antigen-based serologies in a community-wide study in northern Argentina. Clinical
and Vaccine Immunology, 17(10), 1624-1630. https://doi. org/10.1128/CVI.00259-10
Organización Mundial de la Salud. (2021). Poner fin a la desatención para alcanzar los Objetivos
de Desarrollo Sostenible: hoja de ruta sobre enfermedades tropicales desatendidas 2021-2030
[Ending the neglect to attain the Sustainable Development Goals: a road map for neglected
tropical diseases. https://www.who.int/es/publications/i/item/9789240010352
Repetto, S. A., Braghini,
J. Q., Risso, M. G., Argüello,
L. B., Batalla, E. I., Stecher, D. R., Sierra, M. F., Burgos, J. M., Radisic,
M. V., González Cappa, S. M., & Ruybal, P. (2022). Molecular typing
of Strongyloides stercoralis in Latin America, the clinical connection. Parasitology, 149(1), 24-34. https://doi. org/10.1017/S0031182021001517
Taranto, N. J., Cajal, S. P., De Marzi, M. C., Fernández, M. M., Frank, F.
M., Brú, a M., Minvielle, M. C., Basualdo, J. A, & Malchiodi, E. L. (2003).
Clinical status and parasitic infection in a Wichí Aboriginal community in Salta, Argentina. Transactions of the Royal Society of Tropical Medicine & Hygiene,
97(5), 554-558. http://www.ncbi. nlm.nih.gov/pubmed/15307425
Vargas, P., Krolewiecki, A. J., Echazú, A., Juarez,
M., Cajal, P., Gil, J. F., Caro, N., Nasser, J., Lammie,
P., & Cimino, R. O. (2017). Serologic monitoring of public health
interventions against Strongyloides stercoralis. The American Journal of Tropical
Medicine and Hygiene,
97(1). https://doi.org/10.4269/ ajtmh.16-0857
